SOLOとはStructure of Observed Learning Outcomesのことです。知識や技能の浅い理解から深い理解への分類で理論ではなく、エビデンスに基づく分類体系です。学習者が知識や技能を獲得していく過程の研究から生まれたものです。1982年のBiggsとCollisを嚆矢とします( Biggs JB, Collis KF: Evaluating the Quality of Learning: The SOLO taxonomy. 1982, New York: Academic Press. )。カリキュラムを作成する際に用いるタキソノミーすなわち分類体系と呼ばれるもののひとつです。
学習目標/アウトカムの知識、技能、態度すなわちコンピテンスが小さな単位に分割(全体の一部)され単独のものから、それらが複数集まったものになり、更に関連付が強化され、抽象化され他の領域ともつながるということになります。浅い理解から深い理解へということです。
他には理論に基づくBloom’s taxonomyというのが知られています。(Bloom BS, Engelhart MD, Furst EJ, Hill WH, Krathwohl DR (Eds): Taxonomy of Educational Objectives: The classification of Educational Goals – Handbook 1 Cognitive Domain. 1956, David McKay, New York, NY, USA. )こちらの方は、 知識の形式と知識の獲得・利用とが同列に扱われていることが問題点として指摘されています。
Hook & Millsはその著書で、SOLO taxonomyを用いることで、以下のことが実現できると述べています。
学習者と教師は
•学習企図と学習経験を思慮深くデザインできる。
•有効な方略と成功の基準を決めて、用いることができる。
•学習アウトカムのフィードバックと事前のアセスメントを提供することができる。
•次に何をすべきかについて意味のある振り返りができる。
(Hook P, Mills J: SOLO Taxonomy: A guide for Schools BK1: A common language of learning. 2011, Essential Resources Educational Publishers Limited, Laughton, UK.
Hook P, Mills J: SOLO Taxonomy: A Guide for Schools. Planning for differentiation. Book 2. 2011, Essential Resources Educational Publishers Limited, New Zealand. )
SOLO taxonomyでは学習アウトカムあるいは学習目標を以下の図および表に示すように分類します。アウトカムあるいは目標は知識だけでなく技能、態度にも適用できるはずです。


各レベルに対して、使用する動詞がおよそ決められていますが、それぞれの対象領域において必要なものを追加する必要があります。
たとえば、単構造では以下の動詞が用いられます。
define(定義する)
identify(同定する)
name(名前を言う)
find(見つける)
label(分類する)
match(合わせる)
follow a simple procedure(簡単な手順に従って作業する)
多構造では、
describe(記述・説明する)
list(列挙する)
outline(アウトラインを述べる)
follow an algorithm(アルゴリズムに従って作業する
combine(結合する)
関連多構造では、
sequence(並べ替える)
classify(分類する)
compare and contrast(比較対照する)
explain causes(原因を説明する)
explain effects(効果を説明する)
analyze (part-whole)(部分-全体を分析する
form an analogy(アナロジーを形成する)
organize(整理、構成する)
distinguish(区別する)
interview(インタビューする)
question(質問する)
relate(関連付ける)
apply(適用する)
拡張抽象的では、
generalize(一般化する)
predict(予測する)
evaluate(評価する)
reflect(振り返る)
hypothesize(仮説を立てる)
theorize(理論化する)
create(創造する)
prove(証明する)
plan(計画する)
justify(正当化する)
argue(論じる)
compose(構成する)
prioritize(優先順位を付ける)
design(デザインする)
construct(組み立てる)
perform(遂行する、実演する)
そして、HOT SOLO mapが学習支援のために用意されます。
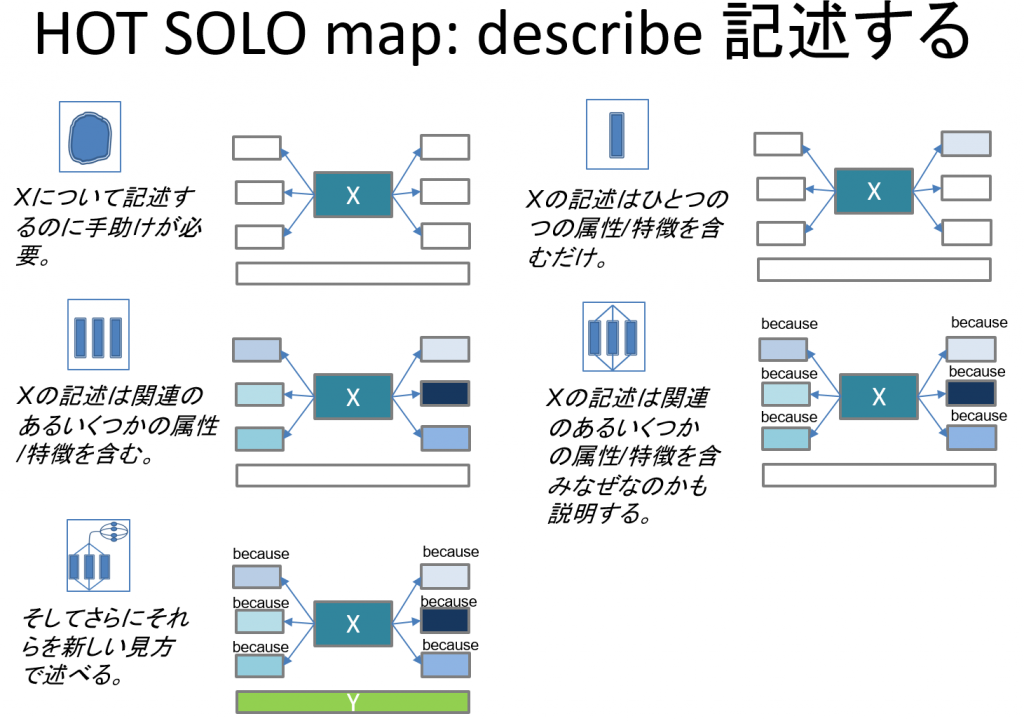
HOT SOLO mapもその知識・概念の構造、学習アウトカムによってさまざまなものが使われます。これらはまた、学習者のセルフアセスメントにも使われます。
また、学習アウトカムを記述する際のボキャブラリーも最初に提供されます。
学習者は自分に次の問いかけをしながら学習を進めていきます。教師の側はこれらの質問に対応する資料を用意する必要があります。
自己管理のための三つの質問
1.どこに進んでいるか?
学習作業、ゴール、企図(SOLOコード)
成功/合格の基準 (SOLOで仕分けされた異なるレベル)
2.どれくらい進んでいるか?
基準に対して進行状況を自己査定
3.次はどこへ進むか?
次の学習ステップ
新しいゴール

