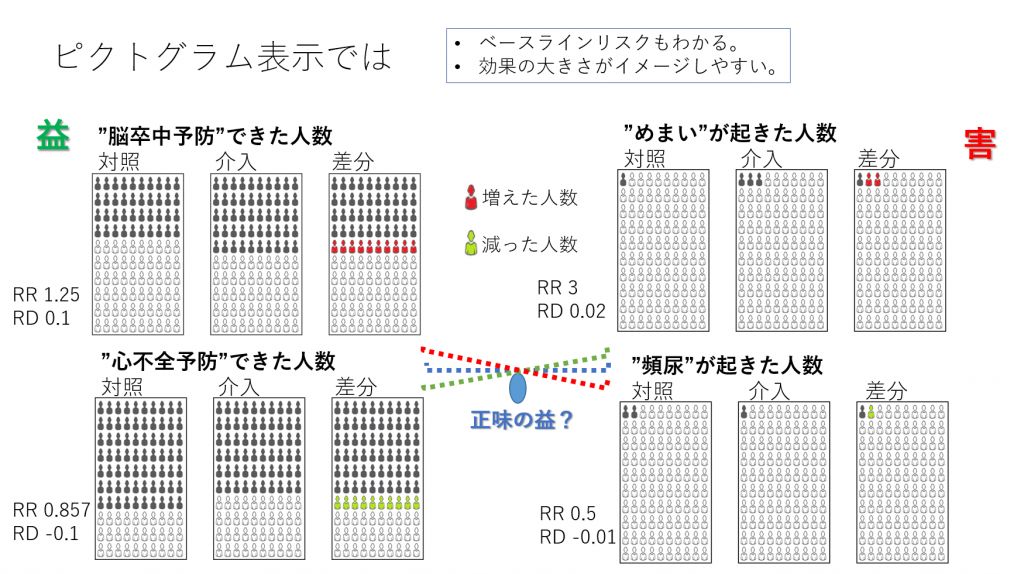
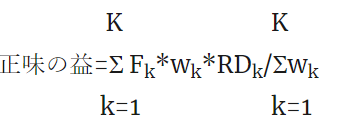Evidence-Based Medicine (EBM)におけるClinical Expertise 臨床的専門能力あるいは臨床的エキスパティーズについて、Haynesらのこのような図を見たことがある人は多いと思います。EBMはエビデンスだけで意思決定を行い、医療を行うのではないことを解説する文脈で用いられていることが多いと思います。

さて、科学的エビデンスだけではなく、臨床的状態・状況、患者の好み(価値観)と行動に臨床的エキスパティーズを統合して医療が行われると単純な理解でいいでしょうか?Wieten Sが2018年に発表した論文で深い考察をしているので、紹介します。
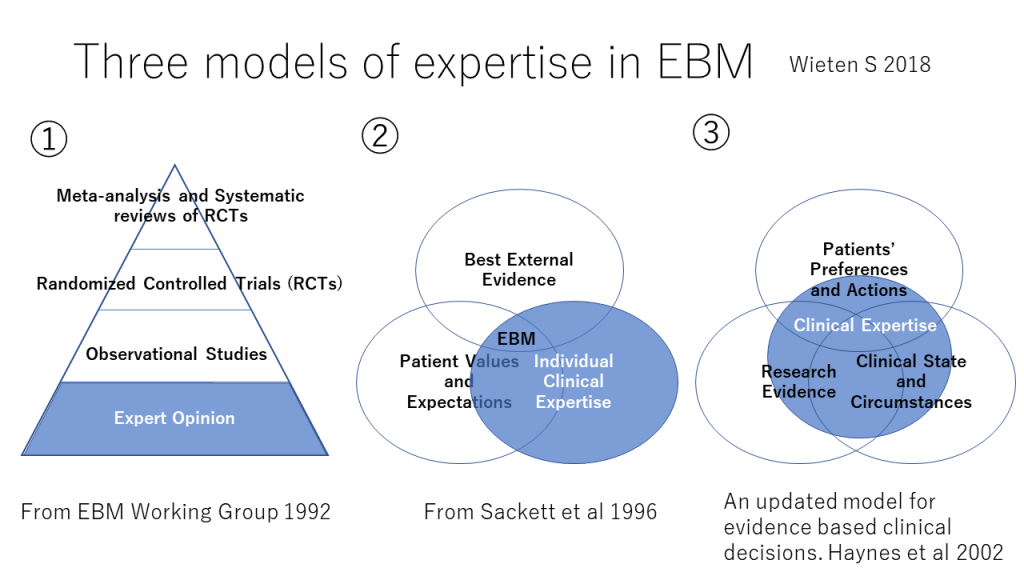
モデル①: 「EBMは、臨床決断において、1.直感、2.系統的でない臨床経験、3.病態生理学的理論的根拠を重要視せず、臨床研究からのエビデンスの調査を強調している」。このような考え方から、モデル①が生まれた。ここで示されている、エビデンスピラミッドの層はひとつの例であるが、このようなエビデンスピラミッドのいずれの場合も、最低レベルは背景情報または臨床的エキスパティーズになっている。専門家の意見をエビデンス内に含め、それを一番下位に位置付ける考え方である。Wieten Sによれば、GRADEアプローチは専門家の経験(に基づくデータ)はエビデンスのひとつとみなし、エビデンスの評価に必要な専門家の判断・意見はエビデンスの外側に位置付けている。
モデル②:「個人の臨床的エキスパティーズは、臨床家個人が臨床経験、臨床実践を通じて、獲得した熟練と判断を意味する。エキスパティーズの向上は様々な面に反映されるが、特に、効果的で効率的な診断と、患者に対する臨床決断における患者の苦悩、権利、好みのより思慮深い同定とより共感的使用に反映される」。この記述から作成されたのがモデル②の図である。モデル②では、エキスパティーズをエビデンスから分離しており、モデル①とその点で異なる。最善の外的エビデンス、患者の価値観と期待、個人の臨床的エキスパティーズのVennダイアグラムの3要素が重なったところにEBMが置かれている。
モデル③:患者の好みと行動、研究エビデンス、臨床状態と状況の3つの要素の中央に臨床的エキスパティーズが置かれている。(これが最初に図1に示したものです。)臨床的エキスパティーズは臨床的スキルだけでなく、患者の臨床状態と臨床状況と研究エビデンス・患者の好みや行動すべてのバランスをとる能力も含まれる。研究エビデンスを解釈し、状況に対応して、様々なトレードオフを仕分け、その患者に最善の医療を実行するために、臨床的スキルを獲得し、研ぎ澄ますことが求められる。患者とのコミュニケーションが重要であり、患者の希望、好み(価値観)を確認しながら、情報を得たうえでの選択ができるように、患者の必要とする情報を提示することが今まで以上に求められている。
臨床的エキスパティーズはエビデンスの一部を占めることもあるが、大部分はエビデンスの外側にある。臨床的エキスパティーズは、診断、予後判定、効果的な患者とのコミュニケーション、正しい治療や診断の実行、ポピュレーションに基づくエビデンスを特定の個人としての患者へ適用することを含む。そして、患者の好みと行動、研究エビデンス、臨床状態と状況の3つの要素をまとめる力である。
これら3つのモデルは、互いに排他的なものではなく、それぞれに臨床に有用な情報を含んでいる。
Wieten Sは、さらに、エキスパティーズとは何かについて、哲学的考察を行っており、「考えなくても、連続して熟練した作業ができることflow of skilled coping」(Hubert Dreyfus)、「社会的に認知された政治的パワーをもつ専門的能力」(Stephan Turner)(GOBSAT Good Old Boys Sit Around A Tableのようなもの)、「統計学的予測ルールなどを用いないで直観力による判断ができること」Michael Bishop & JD Trout)、「その分野を熟知しており独自の貢献ができること(contributory expertise)または独自の貢献はできないがその分野の言語をマスターしていること(interactional expertise)」(Harry Collins & Robert Evans)について解説している。
さて、モデル③について自分の追加的考察を述べておきます。研究エビデンスを正しく理解していても、臨床的スキルが無ければ、介入を実行することはできないということは明白です。すべての医療はその医療者のコンピテンシー=臨床的エキスパティーズ+αを通じて実現することは否定のしようがありません。例えば、内視鏡的に治療可能な早期胃癌で、5年生存率は95%以上だと分かっていても、ESD Endoscopic Submucosal Dissectionができなければ、その医療は実現できません。また、委託可能なレベルでESDが出来るようになるにはどうしたらいいかは臨床研修の課題になります。
患者の好みと行動、研究エビデンス、臨床状態と状況の3つの要素から、実際の医療を実現できるかどうかは、臨床的エキスパティーズによって決まってきます。そして、EBMのステップ2,3のエビデンスの検索と批判的吟味は臨床的エキスパティーズの一部でしかありませんし(以前の投稿参照)、EBMのステップ4の患者への適用には深い理解と科学的・論理的深い思考が必要です。特に、エビデンスの検索と批判的吟味はシステマティックに行わないと、ひとつの論文の批判的吟味だけでは間違った結論に到達するリスクがあります。Shared Decision Making協働意思決定の能力も臨床的エキスパティーズに含まれます。
臨床決断Clinical Decision MakingあるいはMedical Decision Makingを科学的・論理的に行う能力は臨床的エキスパティーズに含まれることは明白ですが、決断の科学Decision Science、たとえばMulti-Criteria Decision Analysis (MCDA)などの知識・スキルが必要になり、これらは少なくともわが国では通常のEBMの教育コンテンツが十分カバーしているとはいいがたい状況です。EBMが臨床的エキスパティーズを包含しているというより、臨床的エキスパティーズがEBMのコンピテンシーを包含していると考えるべきですし、実際の医療も臨床研修もそのような構造で行われています。
EBMは学問の体系ではなく、医療実践の体系で、EBMのコンピテンシーは実践のために個人レベルで必要な知識、スキル(技能)、態度、価値観のことです。
Wieten Sの論文を熟読した上で、自分でも熟考することをお勧めします。
文献:
Wieten S: Expertise in evidence-based medicine: a tale of three models. Philos Ethics Humanit Med 2018;13:2. doi: 10.1186/s13010-018-0055-2 PMID: 29394938
Haynes RB, Devereaux PJ, Guyatt GH: Physicians’ and patients’ choices in evidence based practice. BMJ 2002;324:1350. doi: 10.1136/bmj.324.7350.1350 PMID: 12052789
Sackett DL, Rosenberg WM, Gray JA, Haynes RB, Richardson WS: Evidence based medicine: what it is and what it isn’t. BMJ 1996;312:71-2. doi: 10.1136/bmj.312.7023.71 PMID: 8555924
Evidence-Based Medicine Working Group: Evidence-based medicine. A new approach to teaching the practice of medicine. JAMA 1992;268:2420-5. doi: 10.1001/jama.1992.03490170092032 PMID: 1404801