Institute of Medicine (IOM), Guidelines International Network (G-I-N)のCOIに関する解説、COIへの対処法などについて、重要な箇所の原文と日本語訳です。これを読むとCOIについての理解が深まり、診療ガイドライン作成におけるCOIへの対処法が理解できると思います。
---------------------------------
Institute of Medicine 2009年の定義
“A set of circumstances that creates a risk that professional judgment or actions regarding a primary interest will be unduly influenced by a secondary interest” (IOM, 2009, p. 46).
「もっとも重要な一次的利害に関する専門的判断あるいは行動が二次的利害に不当に影響を受けるリスクを生じる一連の状況」
Clinical Practice Guidelines We Can Trust 2011年に引用されている。
さらにIOMの追加的説明:complementary descriptions of COI: “A divergence between an individual’s private interests and his or her professional obligations such that an independent observer might reasonably question whether the individual’s professional actions or decisions are motivated by personal gain, such as financial, academic advancement, clinical revenue streams, or community standing”
「独立した観察者が、個人の専門的行動あるいは決断が経済的、アカデミックな昇進、臨床的収入の流れあるいは社会的地位のような個人的獲得利益に動機づけられているかどうかについて疑問を抱くかもしれないような、個人の私的利害とその専門家としての義務の間の相違」
さらにSchünemann HJ,らの解説:
“A financial or intellectual relationship that may impact an individual’s ability to approach a scientific question with an open mind” (Schünemann et al., 2009, p. 565).
「開かれた心で科学的疑問にアプローチする個人の能力に影響を与えるかもしれない経済的あるいは知的関係」
さらに知的COIについての説明:
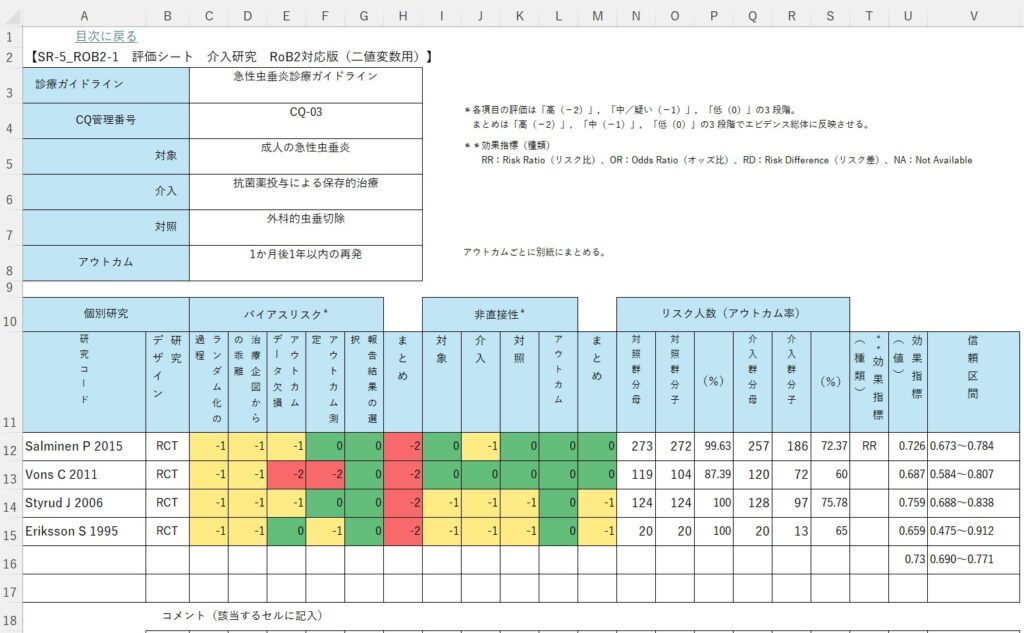
intellectual COIs specific to CPGs are defined as “academic activities that create the potential for an attachment to a specific point of view that could unduly affect an individual’s judgment about a specific recommendation” (Guyatt et al., 2010, p. 739)
「診療ガイドラインに特異的な知的COIは、特異的な推奨に関する個人の判断に不当に影響しうる特異的な見解への執着の可能性を生み出すアカデミックな活動と定義される」
G-I-N 2016の定義
G-I-N 2016の定義はIOMの追加的説明と同じ内容である:
“A divergence between an individual’s private interests and his or her professional obligations such that an independent observer might reasonably question whether the individual’s professional actions or decisions are motivated by personal gain, such as direct financial, academic advancement, clinical revenue streams, or community standing.”
ーーーーー 第4章(75~107ページ)
1. Establishing Transparency
1.1 The processes by which a CPG is developed and funded should be detailed explicitly and publicly accessible.
2. Management of Conflict of Interest (COI)
2.1 Prior to selection of the guideline development group (GDG), individuals being considered for membership should declare all interests and activities potentially resulting in COI with development group activity, by written disclosure to those convening the GDG:
• Disclosure should reflect all current and planned commercial (including services from which a clinician derives a substantial proportion of income), noncommercial, intellectual, institutional, and patient–public activities pertinent to the potential scope of the CPG.
2.2 Disclosure of COIs within GDG:
• All COI of each GDG member should be reported and discussed by the prospective development group prior to the onset of his or her work.
• Each panel member should explain how his or her COI could influence the CPG development process or specific recommendations.
2.3 Divestment
• Members of the GDG should divest themselves of financial investments they or their family members have in, and not participate in marketing activities or advisory boards of, entities whose interests could be affected by CPG recommendations.
2.4 Exclusions
• Whenever possible GDG members should not have COI.
• In some circumstances, a GDG may not be able to perform its work without members who have COIs, such as relevant clinical specialists who receive a substantial portion of their incomes from services pertinent to the CPG.
• Members with COIs should represent not more than a minority of the GDG.
• The chair or cochairs should not be a person(s) with COI.
• Funders should have no role in CPG development.
3. Guideline Development Group Composition
3.1 The GDG should be multidisciplinary and balanced, comprising a variety of methodological experts and clinicians, and populations expected to be affected by the CPG.
3.2 Patient and public involvement should be facilitated by including (at least at the time of clinical question formulation and draft CPG review) a current or former patient, and a patient advocate or patient/consumer organization representative in the GDG.
3.3 Strategies to increase effective participation of patient and consumer representatives, including training in appraisal of evidence, should be adopted by GDGs.
4. Clinical Practice Guideline–Systematic Review Intersection
4.1 Clinical practice guideline developers should use systematic reviews that meet standards set by the Institute of Medicine’s Committee on Standards for Systematic Reviews of Comparative Effectiveness Research.
4.2 When systematic reviews are conducted specifically to inform particular guidelines, the GDG and systematic review team should interact regarding the scope, approach, and output of both processes.
1. 透明性の確保
1.1 CPGの作成と資金調達の過程は明確、詳細で公衆がアクセスできるようにすべきである。
2. 利益相反(COI)の管理
2.1 ガイドライン作成グループ(GDG)の選任に先立ち、参加を考慮中の個人は作成グループの活動とCOIを生じうるすべての利益と活動を招集者に書面で申告すべきである。
・申告は現在の、そして計画されている、CPGの想定されるスコープに関連する商業的(そこから収入のかなりの部分を得ている業務・サービスも含む)、非商業的、知的、患者‐公衆に関する活動のすべてを反映すべきである。
2.2 GDG内でのCOIの申告:
・GDGメンバーのすべてのCOIはその仕事を開始する前に報告され、将来の作成グループによって議論されるべきである。
・各パネルメンバーはそのCOIが診療ガイドライン作成プロセスあるいは個別推奨にどのように影響しうるかを説明すべきである。
2.3 (株式などの)処分
・GDGメンバーは各自および家族が保有する経済的投資を自ら売却・処分すべきで、その利益が診療ガイドラインの推奨により影響を受けうる企業体のマーケティングあるいはアドバイザリーボードに参加すべきではない。
2.4 除外規定
・可能な限りGDGメンバーはCOIを有するべきではない。
・いくつかの状況では、メンバーは診療ガイドラインに関連のあるサービスから収入のかなりの部分を得ている関連のある臨床専門家のような、COIを有するメンバーなしでその仕事を遂行できないかもしれない。
・COIを有するメンバーはGDGの少数派にとどめるべきである。
・ 議長あるいは副議長はCOIを有する者であってはならない。
・資金提供者はCPG作成で何らかの役割を持ってはならない。
3. ガイドライン作成グループの構成
3.1 GDGは方法論の専門家、臨床家、そして診療ガイドラインで影響を受けるであろう集団などさまざまな人々から構成され、多くの専門分野のバランスがとれた構成にすべきである。
3.2 患者と公衆の参画は現在の患者あるいは疾患経験者、患者支援者あるいは患者・医療利用者団体の代表者をGDGに含むことで(少なくともクリニカルクエスチョン作成時点と診療ガイドライン草稿のレビューの時点で)強化すべきである。
3.3 エビデンスの批判的吟味のトレーニングを含む、患者と医療利用者の代表の効果的な参加を増やす戦略がGDGにより採用されるべきである。
4. 診療ガイドライン-システマティックレビューの交差
4.1 診療ガイドライン作成者はInstitute of Medicineの比較効果研究のシステマティックレビューのスタンダードにより設定された基準を満たすシステマティックレビューを用いるべきである。
4.2 システマティックレビューが特定のガイドラインに情報を与えるために特異的に実施される時は、GDGとシステマティックレビューチームは両者のスコープ、アプローチ、そしてアウトプットについて協働すべきである。
文献
IOM. 2009. Conflict of interest in medical research, education, and practice. Edited by B. Lo and M. J. Field. Washington, DC: The National Academies Press, USA.
Guyatt G, Akl EA, Hirsh J, Kearon C, Crowther M, Gutterman D, Lewis SZ, Nathanson I, Jaeschke R, Schünemann H: The vexing problem of guidelines and conflict of interest: a potential solution. Ann Intern Med 2010;152:738-41. PMID: 20479011
Schünemann HJ, Osborne M, Moss J, Manthous C, Wagner G, Sicilian L, Ohar J, McDermott S, Lucas L, Jaeschke R, ATS Ethics and Conflict of Interest Committee and the Documents Development and Implementation Committee: An official American Thoracic Society Policy statement: managing conflict of interest in professional societies. Am J Respir Crit Care Med 2009;180:564-80. PMID: 19734351
G-I-Nの9つの原則
1.ガイドライン作成者は直接的なCOIあるいは関連のある間接的COIを有する者をメンバーに含まないために可能な限り努力すべきである。
2.COIの定義とその管理は、専門性あるいは代表しているステークホルダに関わらず、ガイドライン作成グループの全員に適用され、これはパネルが構成される前に決められるべきである。
3. ガイドライン作成グループは利害申告に標準化されたフォームを用いるべきである。
4.ガイドライン作成グループはすべての直接的な経済的および間接的COI含む利害を公開すべきで、これらはガイドライン利用者が容易に閲覧できるようにすべきである。
5.ガイドライン作成グループのすべてのメンバーはグル―プの会議のたびにそして定期的に(例えば、ガイドライン作成グループのにいる間は1年ごとに)利害の変更について申告し更新すべきである。
6.ガイドライン作成グループの議長は直接的あるいは関連のある間接的COIを有するべきではない。議長の直接的あるいは間接的COIが避けられない場合、ガイドラインパネルをリードするCOIのない副議長を任命すべきである。
7.関連のあるCOIと特異的な知識あるいは専門性を持つ専門家は個々のトピックの議論への参加を許可しうるが、意見を求められる委員の間で適切なバランスがとられるべきである。
8.推奨の方向と強さを決めるガイドライン作成グループのメンバーは誰も直接的な経済的COIを有するべきではない。
9.統括委員会はCOIに関連した規則の作成と実行に責任を持つべきである。
補足:
1-.G-I-Nはそれが実際的でない場合に、例外が必要なことを認識しているが、そのような問題がこの原則の重要性を減少させるものではない。パネルメンバーがCOIを有する場合、COIを有するメンバーがガイドラインパネルで少数派になるように、そしてガイドライン作成者はCOIを有するメンバーを含める理由についてそしてCOIの管理について透明性を確保すべきである。
4-.COIはさまざまな設定のさまざまなレベルで起きるので、この開示の部分では診療ガイドライン作成グループはすべての特異的な金銭的価値のあるものを開示すべきである。もしわかるのであれば、実際のあるはおおよその金額を報告することは透明性を高める。開示のレジストリーを使うことが可能である。
6-.推奨の向きと強さに影響する場合は関連のあるCOIが存在する。そのようなCOIがない副議長の例は推奨の向きと強さに関係のある利害を持たない方法論専門家がある。
-7.いくつかの設定においては、この役割を満たせる者は診療ガイドライン作成グループの投票するあるいは投票しないメンバーではない専門的アドバイザーと考えてもよい。
-8.これらのメンバーはガイドライン作成の時点に参加すべきではない。彼らは、推奨の方向と強さに関する議論の場にはいないこと。
-9.統括委員会は論争になる問題に対処すべきで、診療ガイドライングループの議長に誰が投票し、だれが投票しないメンバーか、そして専門的アドバイザーとしてだれを指名するかについてアドバイスすべきである。
文献:
Schünemann HJ, Al-Ansary LA, Forland F, Kersten S, Komulainen J, Kopp IB, Macbeth F, Phillips SM, Robbins C, van der Wees P, Qaseem A, Board of Trustees of the Guidelines International Network: Guidelines International Network: Principles for Disclosure of Interests and Management of Conflicts in Guidelines. Ann Intern Med 2015;163:548-53. PMID: 26436619
低いレベルのCOI (排除なし)
直接的な経済的COIなし
間接的な経済的COなし
直接的な知的COIなし
-トピック領域で推奨を発表したことが無い
-違うトピック領域ではガイドライン作成をしたことがある
対応:全面的参画
中等度のレベルのCOI (部分的排除)
直接的経済的COI
-ガイドラインと関係のないトピック領域で雇用主への研究費を企業から受けている
-ガイドラインに直接関係のあるトピック領域で非営利組織(例えば、AHRQ、NIHなど)から資金を受けている
個人的な経済的COI
-製薬企業から近親者が資金提供を受けているが、ガイドラインのトピックとは関係がない。
直接的知的COI
– 別の組織のために同じガイドライントピックで仕事をしたことがある
対応:議論には参加するが、パネル、著者、投票には参加しない。
高いレベルのCOI(完全排除)
直接的な経済的COI
-講演、株式、ボードメンバー
-近親者がガイドラインに直接関係のある製品について製薬企業から金銭を受け取る、あるいは受け取ったことがある
対応:拒絶
2015年Guidelines International Network (G-I-N)でのプレナリーセッションでのGRADE working groupのHolger SchunemannとAmerican College of Phyisicians (ACP)のAmir Quaseemの発表スライド。