介入の益と害を定量的に評価するためには、絶対効果を知る必要があります。比較する2群の絶対リスクの差が絶対効果です。米AHRQ Agency for Healthcare Research and Quality医療研究・品質調査機構 のShared Decision Making (SMD)共有意思決定に関する、 SHAREアプローチのツール5:数量リテラシーでは次のような表現が使われています。「絶対リスクはひとつのグループでの健康イベントの起きる数の推定値で、より強く個人のリスクを感じさせることができる。たとえば、”喫煙者は一生の間に2倍脳卒中を起こします”というよりも、”1000人のたばこを吸わない人では3人が一生の間に脳卒中を起こし、1000人のたばこを吸う人は6人が一生の間に脳卒中を起こします”と説明すべき。」
これを読むだけで絶対リスクが何かは分かります。つまり、ひとつの群におけるアウトカムの起きた人数の割合で、単位人数当たりの頻度人数でも表すこともできます。”ひとつのグループでの健康イベントの推定値”という表現は非常に適確だと思います。後半部分で述べられている1000分6と1000分の3の差がリスク差です。つまり、暴露群の絶対リスク - 対照群の絶対リスク = リスク差です。ランダム化比較試験で介入の効果を見る場合は、介入群の絶対リスク - 対照群の絶対リスク=リスク差です。1000人あたりの頻度人数として表したいのであれば、リスク差に1000を掛け算します。
以上は、アウトカムが二値変数 binary or dichotomous variableの場合ですが、連続変数の場合は、ひとつのグループでの平均値です。ニ値変数は治癒、非治癒のような排他的な二つの事象のどちらか片方が対象者に起きます。片方が起きる割合を1から引き算するともう片方の起きる割合になります。
さて、ピクトグラムでは絶対リスクやリスク差がどのように表現されるか見てみましょう。

架空の臨床試験ですが、ランダム化比較試験で2つのアウトカムが測定されたとします。アウトカム1は有害事象が測定されましたが、介入によるその減少が推定されており、益のアウトカムとして設定されました。アウトカム2は有害事象が測定され、介入によりその増加が推定されており、害のアウトカムとして設定されました。
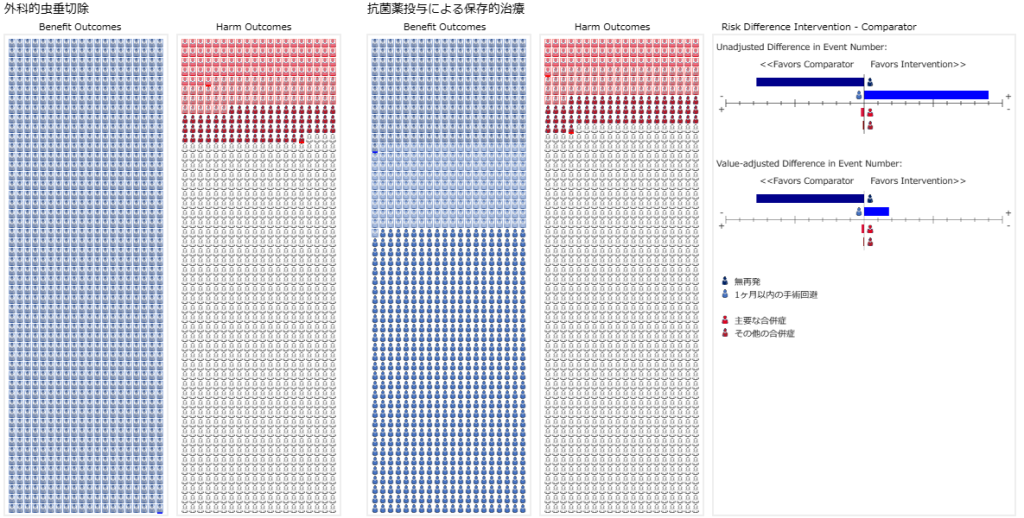
試験の結果を1000人単位のピクトグラムで表すとこのスライドのようになります。 ピクトグラムでは対照群と介入群のそれぞれのアウトカムに対する絶対リスクを表すことができます。このピクトグラムは1行25人で、40行、計1000人単位で一つの群を表しています。
左の2列が対照群、右の2列が介入群で、それぞれ左側は益を得られた人数(Benetif Outcomes)を青、右側は害が起きた人数(Harm Outcomes)を赤で表しています。それぞれ塗りつぶされているアイコンの数が1000人あたりの、対応する人数を表しています。
アウトカム1の場合は、益のアウトカムとして、有害事象が測定されているので、その事象が起きなかった人数を表しています。測定された有害事象であるアウトカム1が起きた人数は対照群で500人、介入群で100人で、有害事象が減少しましたが、それぞれ1000から引き算した人数をプロットしてあります。アウトカム2の場合は、有害事象が測定されているので、そのままその事象が起きた人数を表しています。
もし、2つのアウトカムの重要度が同じであれば、対照群でBenefit Outcomesの人数から、Harm Outcomesの人数を引き算すると対照群の正味の益Dcが1000人あたりの人数として得られます。この例では、Dc=500-50 = 450となります。介入群では、同様に正味の益Di = 900-100 = 800となります。介入群の正味の益から対照群の正味の益を引き算すると、この介入によって得られる正味の益になります。すなわち、800 – 450 =350が、アウトカムの重要度を同じとみなした場合の、1000人あたりでの正味の益を表します。しかし、2つのアウトカムの重要度が同じという場合は稀でしょう。
アウトカム1の重要度を100とし、アウトカム2の重要度を20とした場合は、対照群の重要度で調整された差aDc=500 – 50×20/100 = 490、介入群の重要度で調整された差aDi=900-100×20/100 = 880となり、介入により得られる正味の益は880-490 =390となります。すなわちアウトカム1の価値に合わせた場合、1000人あたり390人がそれだけの価値のアウトカムが起きることを示します。ピクトグラムではHarm Outcomesのシェードをつけたアイコンが重要度で重みづけした頻度人数を表しています。Benefit Outcomesはアウトカム1に対応しており、測定されたアウトカム1が起きなかった、1000人あたりの人数を表しており、重要度は100にしたので、全数がシェードがついたアイコンになります。
アウトカム2はアウトカム1の5分の1の重要度なので、アウトカム1のスケールに合わせた場合、50人分を10人分、100人分を20人分とみなすことになります。これら重要度で調整された人数が赤のシェードを付けたアイコンの数になります。
リスク差から計算しても同じ結果が得られます。リスク差を計算する時は、介入群の絶対リスク-対照群の絶対リスクとして計算します。リスク差を計算すると、益のアウトカムであるアウトカム1に対して、測定された有害事象のアウトカムでは、絶対リスク 0.1-0.5 = -0.4ですが、有害事象なのでプラスマイナスを逆にし、RD1 = 0.4となります。RDはRisk Differenceです。害のアウトカムであるアウトカム2に対しては、RD2 = 0.1-0.05 = 0.05となります。アウトカムの重要度で調節しないと、正味の益=0.4-0.05=0.35となりますが、アウトカムの重要度で調整すると、正味の益=1×0.4-0.2×0.05=0.39となります。これらを1000人あたりに換算すると、390人となります。
おなじランダム化比較試験の結果をリスク差をプロットした横棒グラフにしてみます。

絶対効果 = 介入群の絶対リスク - 対照群の絶対リスク、すなわちリスク差 で計算し、介入群が優位のアウトカムは右向きの横棒、対照群が優位のアウトカムは左向きの横棒で表すと、この図のようになります。
有益事象がアウトカムとして測定された場合は、介入群が優位の場合、絶対効果はプラスの値になるので、そのまま右向きの横棒として描画します。有害事象がアウトカムとして測定された場合は、介入群が優位の場合、絶対効果はマイナスの値になるので、正負を逆にして右向きの横棒として描画します。X軸の値は0.4、1000人あたりの頻度人数400です。
有害事象がアウトカムとして測定された場合は、対照群が優位の場合、絶対効果はプラスの値になるので、左向きの横棒として描画し、左側がプラスのスケールにします。X軸の値は0.05、1000人あたりの頻度人数50です。
下段のグラフの例は、益のアウトカムの重要度を100、それに対して相対的に、害のアウトカムの重要度を20とした場合の、棒グラフです。イベント数=頻度人数を益のアウトカムの価値に合わせた人数にするため、X軸の値は、それぞれ0.4と0.01、1000人あたりの頻度人数400と10です。
いずれのグラフを見ても、介入によりアウトカム1に相当する益を受けられる人が、390人増えることが分かります。
また、このようなグラフを作成したり、グラフを解釈するには、アウトカムが有害事象なのか有益事象なのか、リスク差がいずれの群を基準にして計算し、値がプラスなのかマイナスなのかに注意が必要です。
今回取り上げた例は、益のアウトカムが1つ、害のアウトカムが1つのシンプルな例ですが、アウトカムの数がもっと多い場合、そして、アウトカムによって、優位となる介入が異なる場合は、複雑な判断が求められ、直感では処理しきれなくなるかもしれません。その時は、Multi-Criteria Decision Analysis (MCDA)のようなQuantitative Benefit-Risk AnalysisあるいはQuantitative Benefit-Harm Analysisが有用と考えられています。
アウトカムの重要度 importance of outcome は意思決定者がそのアウトカムに置く価値の大きさです。Priorities and preferences, Values and preferences, Values, Patient preferencesなどとも呼ばれています。臨床試験の際にこれらの情報を記録することも検討されています。
Valuesですから、個人個人の価値観により異なるのが普通です。その測定法として、Simple direct weighting, Swing weighting, Analytic hierarchy process, Discrete-choice experimentsなど様々な方法(Ho M 2016)が報告されています。
文献(一部のみ):
Tervonen T, Veldwijk J, Payne K, Ng X, Levitan B, Lackey LG, Marsh K, Thokala P, Pignatti F, Donnelly A, Ho M: Quantitative Benefit-Risk Assessment in Medical Product Decision Making: A Good Practices Report of an ISPOR Task Force. Value Health 2023;26:449-460. doi: 10.1016/j.jval.2022.12.006 PMID: 37005055
Brett Hauber A, Fairchild AO, Reed Johnson F: Quantifying benefit-risk preferences for medical interventions: an overview of a growing empirical literature. Appl Health Econ Health Policy 2013;11:319-29. doi: 10.1007/s40258-013-0028-y PMID: 23637054
Ho M, Saha A, McCleary KK, Levitan B, Christopher S, Zandlo K, Braithwaite RS, Hauber AB, Medical Device Innovation Consortium’s Patient Centered Benefit-Risk Steering Committee: A Framework for Incorporating Patient Preferences Regarding Benefits and Risks into Regulatory Assessment of Medical Technologies. Value Health 2016;19:746-750. doi: 10.1016/j.jval.2016.02.019 PMID: 27712701
Janssens R, Barbier L, Muller M, Cleemput I, Stoeckert I, Whichello C, Levitan B, Hammad TA, Girvalaki C, Ventura JJ, Bywall KS, Pinto CA, Schoefs E, Katz EG, Kihlbom U, Huys I: How can patient preferences be used and communicated in the regulatory evaluation of medicinal products? Findings and recommendations from IMI PREFER and call to action. Front Pharmacol 2023;14:1192770. doi: 10.3389/fphar.2019.01009 PMID: 37663265