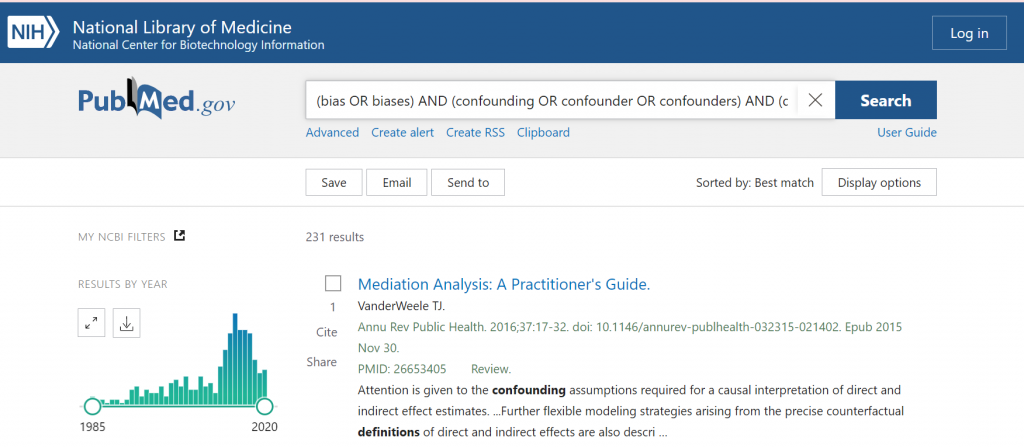
前回の投稿で紹介したElliott JHらのLiving SRに関する論文の内容を紹介したいと思います。従来のSRとの違いと、研究のエコシステムにおけるLiving SRの位置づけについて述べられています。できるだけ原文のまま紹介したいと思います。
従来の通常のシステマティックレビュー(SR)とLiving systematic review (SR)は、出版形式、作業プロセス、著者チームマネージメント、統計学的方法の4つの点で異なる。
1. 出版形式:動的で、持続的で、オンラインのエビデンスのまとめで、更新が早く、頻回である。
2. 作業プロセス:通常のSRとは異なり、文献検索戦略は維持され、アウトプットは連続的にSRのワークフローに追加され、採択される文献、研究の質の評価、データの抽出、メタアナリシス、SRレポートは連続的に更新される。通常のSRあるいはSRの更新の集中的で間欠的な努力の代わりに、Living SRは中等度の進行中の貢献が必要となる。
3. 著者チームのマネージメントは連続的なワークフローに対応し、長期間にわたる協働と著者チームの進化を許容しながら、組織としての記憶が保たれなければならない。
4. メタアナリシスの更新は、データの再解析を伴い、蓄積される一次臨床試験のデータの再解析とともに、もし統計学的検定を単に繰り返すと、偽陽性の所見の率が上昇する。また、エフェクトサイズの推定値は不安定で、特にエビデンス生成の初期段階でそうなる。これらの問題はすべてのメタアナリシスの更新に関連するが、Living SRでは、更新の回数が多くなる可能性が高いので、特に重要となる。正式のSequential methodを用いる方法や、ベイジアンアプローチが有用である。
ワークフローおよび協働作業ツール
セミオートメーション
文献検索・選定作業、バイアスリスクの評価、データ抽出作業への機械学習などAIの活用が進む可能性がある。
データレポジトリとリンクされたデータ
重要なヘルスケアクエスチョン(クリニカルクエスチョン)は多くのSR作成者に共通であり、互いに独立してSRを行うことは、無駄が多い。SRのプロトコールを共通のサイトに登録すること、SRのプロセスや作成データ(アウトプット)を保管し再利用を許可することで繰り返しの無駄を省くことができる。共通の概念に基づいた一定のフォーマットを用いることで、不必要な二重の作業を減らすことができる。
リンクされたデータには以下の様式が用いられるであろう:
W3C: World Wide Web Consortium
RDF:RDFはResource Description Frameworkの略です。 RDFファイル拡張子を含むファイルは、リソース記述フレームワーク言語で記述されたドキュメントである。これらのファイルは、このファイル形式を使用するWebサイトに関する情報を保存するために使用される。
Web Ontology Language ( OWL )は インターネット 上に存在する オントロジー を用いてデータ交換を行うための データ記述言語 。 OWLは RDF の語彙拡張であり、DAML+OILに由来している。
Living SRの出版
オンラインのみの出版により、ピアレビュー、編集委員会のレビューがスピードアップする。
International Committee of Medical Journal Editors (ICMJE)の基準のような出版の基準に従うことを原則とすることで、ノルムを維持できる。著者の変更も正確に反映されるべきである。
医学文献データベースでの取り扱いは、マイナーアップデートの場合、追加分の情報だけを提供し、メジャーアップデートの場合は、新規の出版として掲載する。
研究のエコシステムとLiving SRの関係
Living SRのサイクル:医療Health Practice ー ヘルスケアシステムの学習 – 健康”ビッグデータ” – リンクされたデータレポジトリ – Living システマティックレビュー – Livingエビデンスサービス – Livingガイダンス – 意思決定支援システム – 医療
一次研究のサイクル:医療 – 仮説の優先付け – 一次研究 – 出版 – システマティックレビュー – 出版 – ガイダンス – 知識の翻訳* – 医療
*translationは翻訳という意味であるが、研究結果をまとめた情報を実臨床に使える形に変えることを意味する。
2つのサイクルは赤字で示す一次研究とリンクされたデータレポジトリの部分でつながる。
論文のサマリーから著者らの主張が次のようなものであることがわかる:
我々は、最新であることと正確さを向上させるための厳密さとヘルスエビデンスの活用の両者を結合するエビデンスの統合への貢献として、Living systematic review “生きたシステマティックレビュー”を提案する。
Living systematic reviewは高品質で、新しい研究が得られるたびにアップデートされる最新のオンラインのまとめで、改善された作成効率と学問的コミュニケーションの基準の順守によって可能となる。
一次研究報告の技術革新と健康システムにおけるエビデンスの創生と使用を合わせて、Living systematic reviewは新しいエビデンスエコシステムに貢献する。
以下は投稿者の意見です:Living SRの著者はチームになり、その構成も随時変わっていき、一度出版してもそれで終わりではなく、新しい論文が出たら、すぐに再解析して、書き直して、アップデートを出版しなければならない。その作業の負担はかなり大きいと思われます。その出版を引き受けるジャーナルの側も、迅速なピアレビューが必要で、オンラインで出版しなければならない、旧版の処理など、いろいろな、変革が必要になります。PubMedの対処の仕方は、前回例として解説しました。また、利用者の立場からは、リサーチクエスチョン(クリニカルクエスチョン)がLiving SRになじむものに偏る可能性、それぞれのLiving SRに、臨床決断に必要な情報がすべて含まれていない可能性があることに注意が必要ではないかと思います。
文献:
Elliott JH, et al: Living systematic reviews: an emerging opportunity to narrow the evidence-practice gap. PLoS Med 2014;11:e1001603. doi: 10.1371/journal.pmed.1001603 PMID: 24558353