アウトカムOutcome=評価項目Criteriaの重要度の設定にSwing weightingという方法を用いた、成人の急性虫垂炎の抗菌薬投与による保存的治療と外科的虫垂切除の比較の例について紹介しました。参照:Keeney and Raiffaの方法 急性虫垂炎の例 その解析結果を示します。
まず、再発が無いことを重要視する場合です。下のグラフでアウトカムの右側の数字が設定した重みの値です。重みは0~100の範囲の値で、一番重要と考えたアウトカムは100に設定されます。それ以外のアウトカムには、それに対して相対的な値を設定します。

このような重みづけの組み合わせの場合は、再発が無いことを一番重要と考えていることになりますが、MCDAの結果では、次の様に外科的虫垂切除の方が総スコアAggregate scoreが高くなりました。分布は効果推定値=パラメータの不確実性を全体として反映していますが、各パラメータの間の共分散も含めて分散に掛け算される係数の値も取り込んだ総計に基づき計算しています。
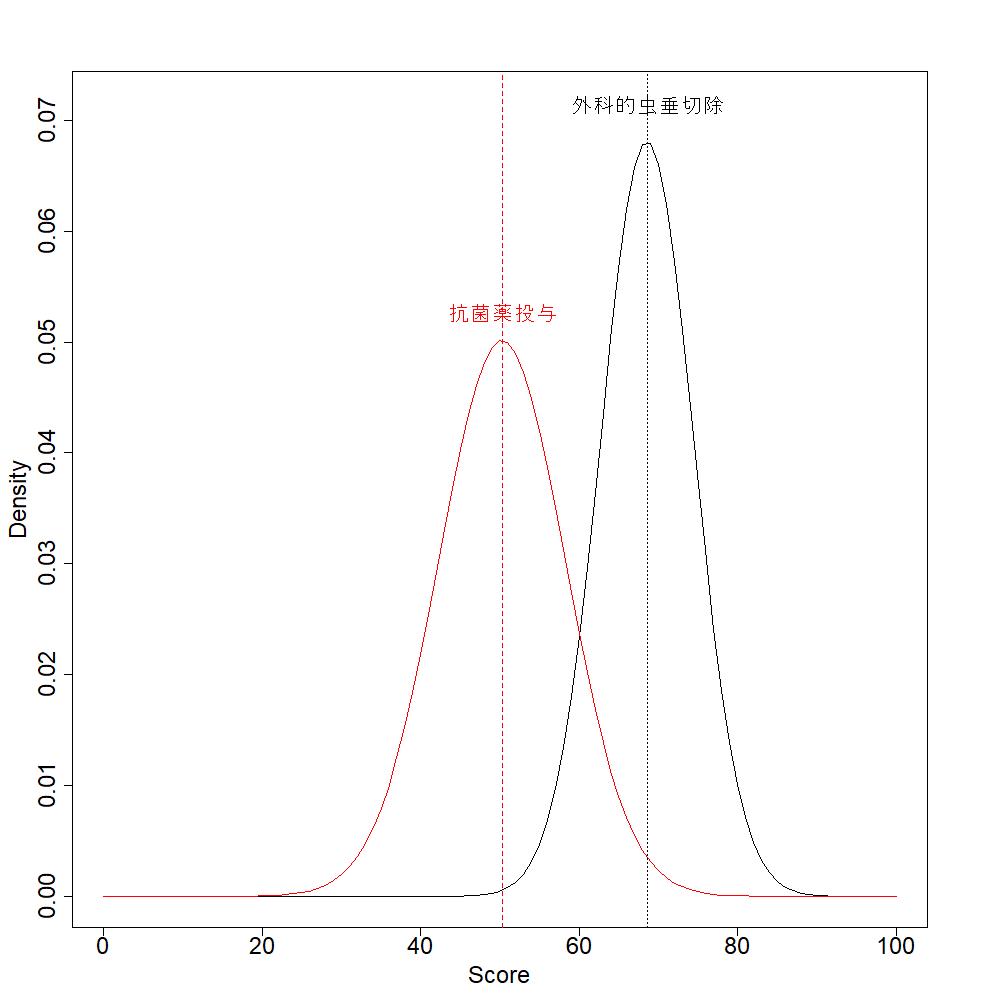
効果推定値は各群の率あるいは平均値で、それらを4つの研究からメタアナリシスの手法でまとめた統合値を用いています。図1の黒の三角が外科的虫垂切除の場合、赤の三角が抗菌薬投与による保存的治療の場合です。率については正規分布に近似することを前提に分散の逆数で重みづけしたランダム効果モデルによる統合値と標準誤差、連続変数の平均値の場合は、分散の逆数で重みづけしたランダム効果モデルによる統合値と標準偏差の値を用いました。最善値、最悪値は二つの選択肢における95%信頼限界の最大値あるいは最小値を用いてスコアリングを行っています。
もし図1で黒または赤の三角のいずれかがすべてのアウトカムで矢じりの側にあれば、それだけでどのような重みづけの場合でも、その介入の方を選択すべきだとわかります。今回の例では、アウトカム毎に相対的位置が異なっており、トレードオフのあることがわかります。
また、もしすべてのアウトカムに対して、ありうる最善の効果の介入があるとしたら、総スコアは100になりますし、すべてのアウトカムに対してありうる最悪の効果の介入があるとしたら0になります。
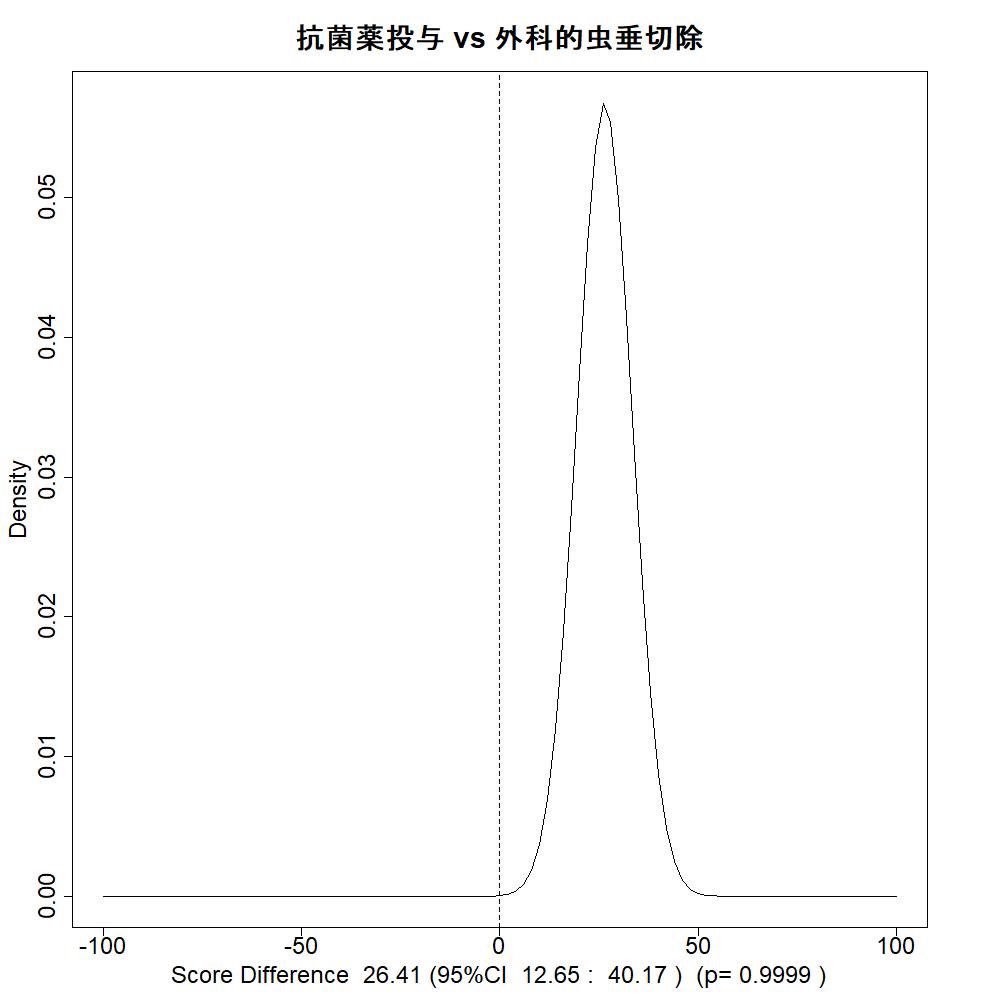
さらに、二つの選択肢の総スコアの差を求めると、外科的虫垂切除を対照としているので、介入―対照の値はマイナスとなり(対照の外科的切除の総スコアの方が大きい)、外科的虫垂切除の方が望ましいという結果になります。その差がプラスになり、介入すなわち抗菌薬投与による保存的治療の総スコアが上回る確率は0.032です。
従って、このような価値観を持つ人の場合は、外科手術を希望するでしょうし、このMCDAの結果もそれを支持しています。

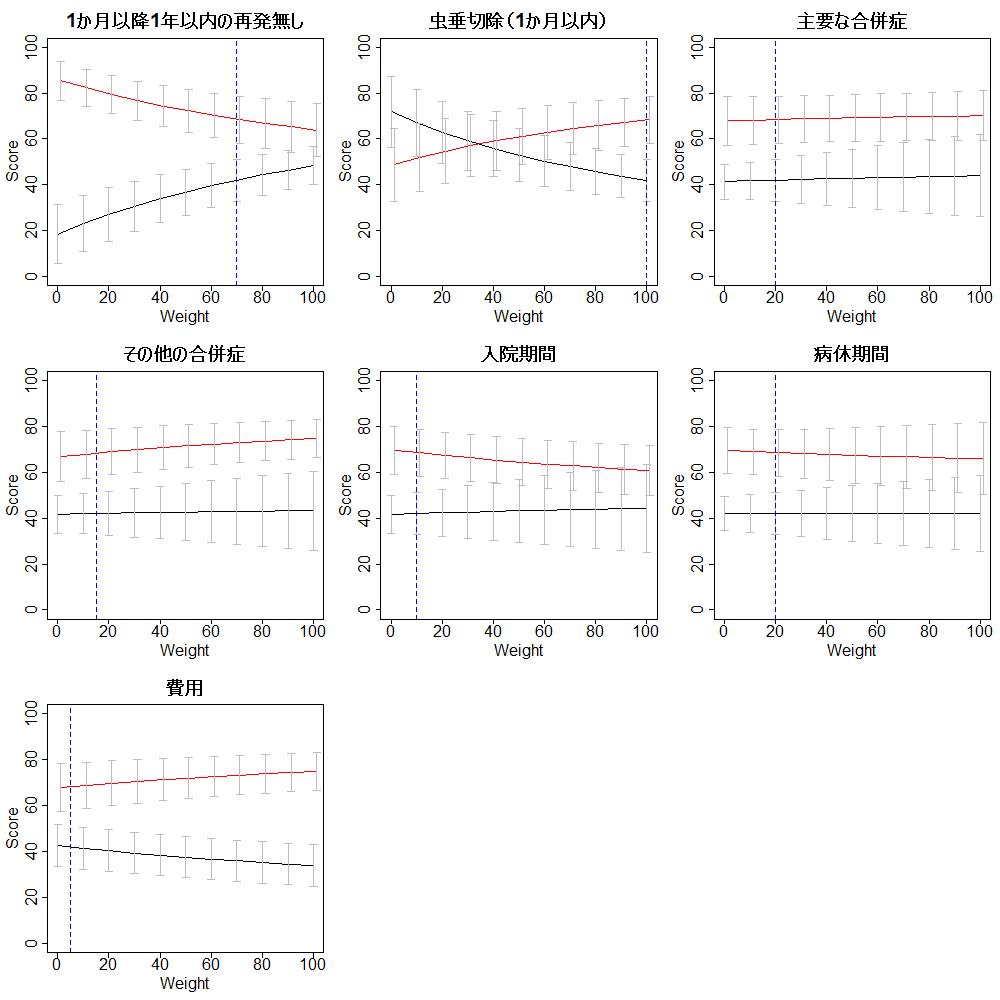
それぞれのアウトカムに対する重みを0から100の間で10ずつ変動させた場合にどうなるか見た、つまり感度分析の、結果が次のグラフです。一つのアウトカムの重みを変える場合、それ以外のアウトカムに対する重みは最初に設定した値のままです。それぞれのグラフで青い点線で示すところが、すべてのアウトカムの重みが最初に設定した値の場合に相当します。縦のバーは95%信頼区間を示します。
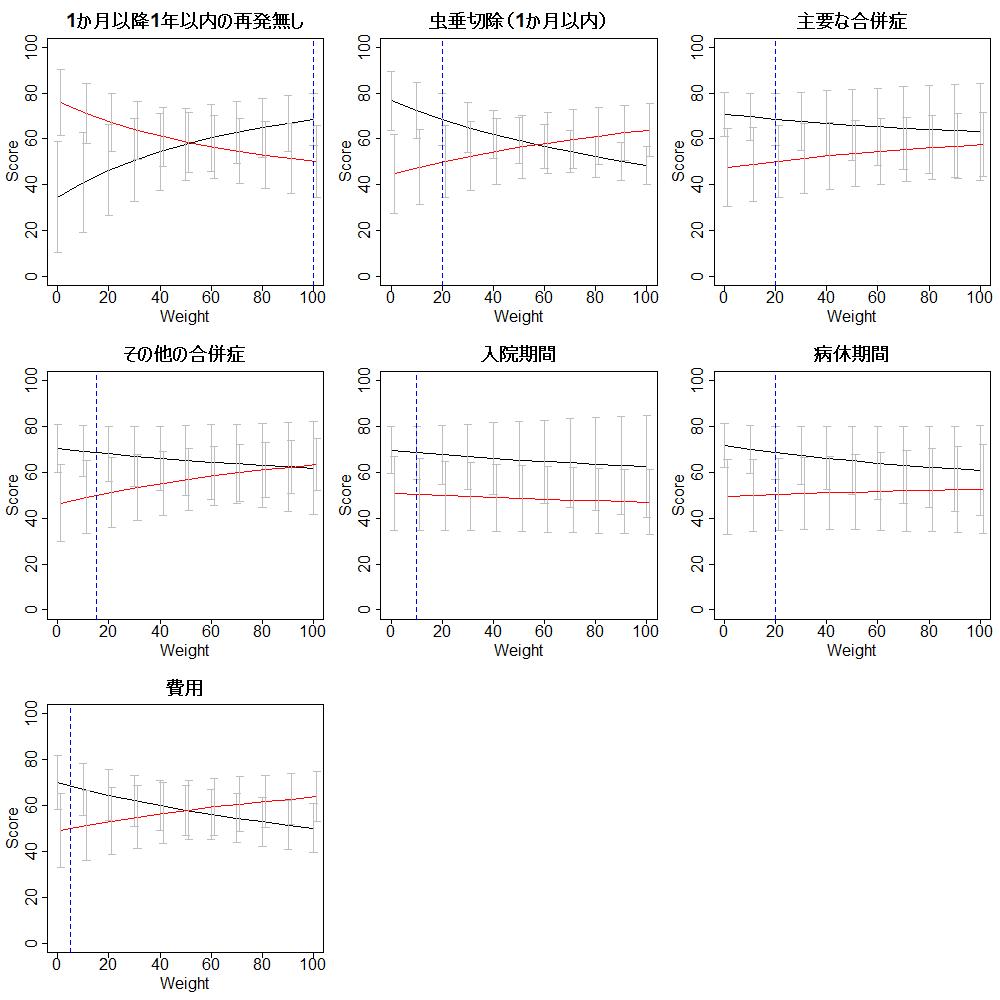
このグラフを見ると、1ヶ月以降1年以内の再発と1か月以内の手術、および費用は重みを変動させるとそれ以外のアウトカムの重みは変えない場合、総スコアが逆転し、抗菌薬投与による保存的治療の総スコアの方がより大きくなりうることがわかります。ただし、費用の重みを50以上にすると、抗菌薬投与による保存的治療の総スコアが外科的虫垂切除の総スコアを上回りますが、1ヶ月以降1年以内の再発や1か月以内の手術といった健康関連アウトカムに対して、費用の重みを50まで増加させることは非常に考えにくいと思います。
それでは、一か月以内に手術を受けないで済むことにもう少し価値を置く場合はどうなるでしょうか。次の図のような重みの場合です。上記の場合とは1ヶ月以内の虫垂切除の重みを20から60に変えたところが違います。他のアウトカムの重みは同じです。
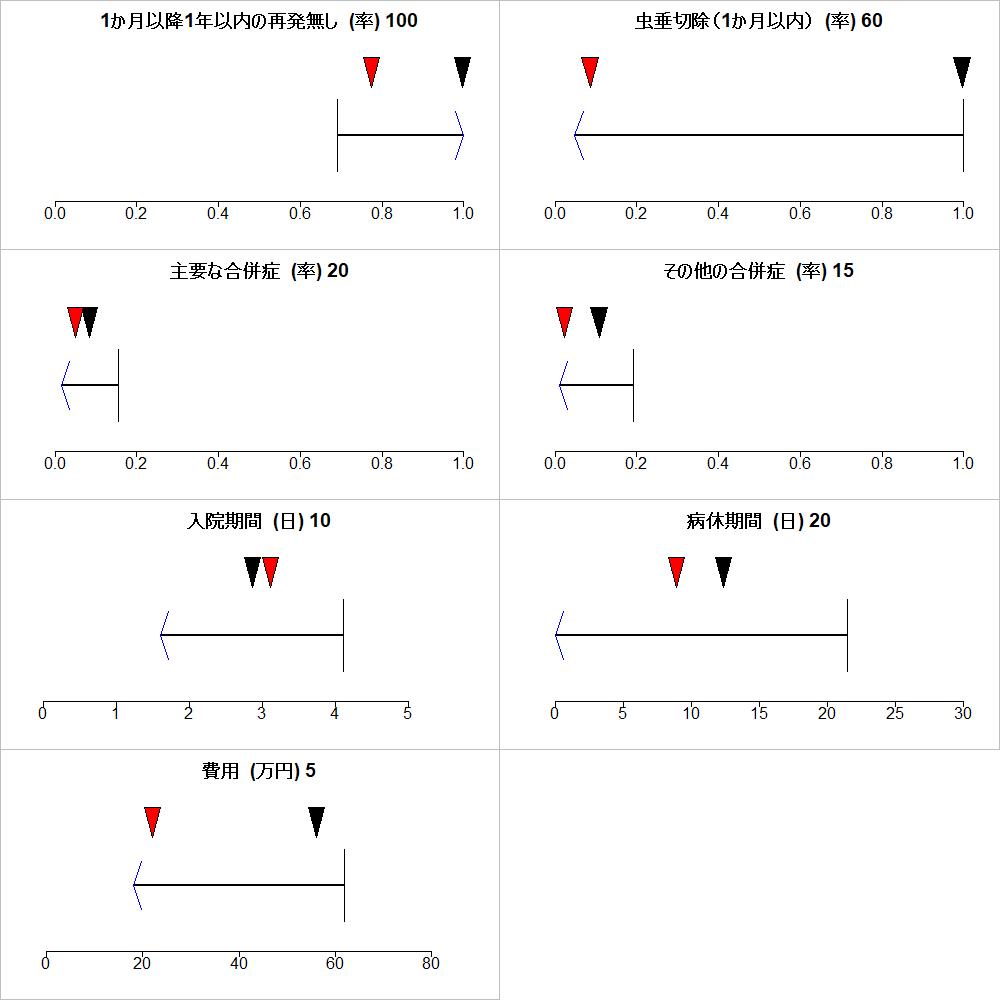

こうすると、2つの選択肢の総スコアはほとんど同じになります。
差でみても同様です。

すなわち、1ヶ月以降1年以内の再発は嫌だから、それを一番重要なアウトカムと考えるが、手術を受けないで済めばそれに越したことはない、というような価値観の人の場合は、どちらがいいか迷うでしょう。このMCDAの結果もそれを支持しているように見えます。どちらの治療選択肢でも価値に大差はないと考えられます。あるいは、再発もなく、手術も受けないで済むという、両方の良いとこ取りはできないということでもあります。
各アウトカムに対する重みを変動させた場合のグラフは次の通りです。この場合は、1ヶ月以内の虫垂切除の重みをより大きくすれば抗菌薬投与による保存的治療の総スコアが外科的虫垂切除の総スコアを上回ります。つまり、外科手術は受けたくないという気持ちが強い場合は抗菌薬投与による保存的治療の総スコアがより大きくなるということです

そして、1ヶ月以内に手術を受けないで済むことに対する重みを100にして、1ヶ月以降1年以内の再発の重みを70にした場合はどうなるでしょうか。この場合は、できるだけ手術を受けないで済むことに最も大きな価値を置くが、再発はある程度許容するという価値観になると思います。

この場合は、当然と言えば当然ですが、抗菌薬投与による保存的治療の総スコアが外科的虫垂切除の総スコアを上回ります。

図10.総スコアの差でみても同様です。
各アウトカムの重みを変動させた場合のグラフは次の通りです。この場合も、1ヶ月以内に手術を受けることの重みを変動させると、逆転が生じます。
さて、これらの解析結果を見ると、Keeny and RaiffaのSwing weightingを用いるMCDA (Multi-Criteria Decision Analysis)はアウトカムの重みづけと総スコアの関係が納得できるものであり、人が感じる価値を正確にとらえることができる方法ではないかと思えます。しかも、元の尺度が異なる値を統合して総スコア化でき、それが人の感覚とよく符合するということは、優れた決断モデルであり、優れた決断分析の手法であると考えられます。なお、ここで示した分析はRを用いて管理者が作成したスクリプトで行いました。

