T個の介入があるとし、介入iの効果を介入jすなわち対照と比較したランダム化比較試験でK個のアウトカムに対する効果がリスク差で得られたとする。そこで、ペアで正味の益を比較するとする。(i, j, T, K, Lは整数)。

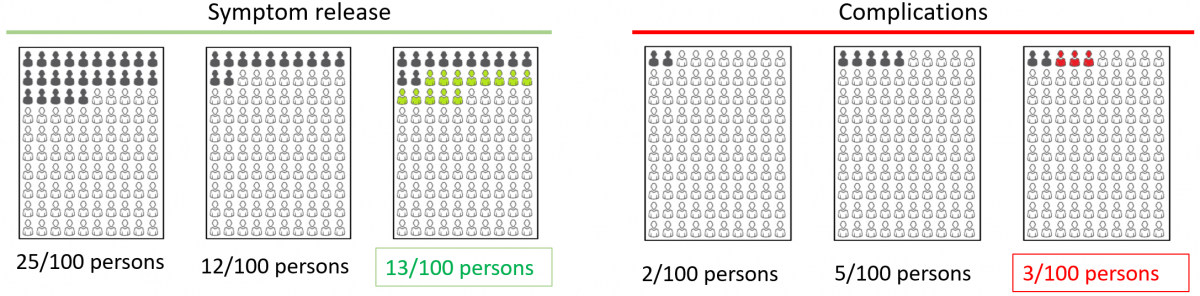
リスク差Eijは介入i、すなわち介入の絶対リスク(イベント率)から介入j、すなわち対照の絶対リスク(イベント率)を引き算した値とする。従って、もし、有害な事象がアウトカムの内容で、Eijがプラスの値であれば、効果は害であり、逆にEijがマイナスの値であれば、益である。もし、有益な事象がアウトカムの内容の場合は、その逆で、Eijがプラスの値であれば、益であり、マイナスの値であれば害となる。ただし、リスク差は介入の絶対リスク-対象の絶対リスクとして計算することをルールとする。
効果推定値と効果の望ましさの関係をもう一度考えてみると、リスク差Eijの値が大きくなる方が望ましい効果の場合は、有益事象がアウトカムの内容であり、逆にEijが小さい方が望ましい効果の場合は、有害事象がアウトカムの内容である。アウトカムの内容とは、測定されたアウトカム事象と言い換えてもいい。正味の益がプラスになれば望ましい効果が望ましくない効果を上回り、マイナスになれば望ましくない効果が望ましい効果を上回るようにするために、アウトカムkに対する係数Fkをアウトカムの内容が有益事象の場合は1、有害事象の場合は-1に設定する。
アウトカムkに対する重要度wkは0~100の値を設定する。最も重要なアウトカムに100を設定し、その他のアウトカムに対しては相対的な重要度を0~100の数値として設定する。アウトカムの重要度は評価者がそのアウトカムに置く価値の大きさであり、評価者の価値観によって決まるので、評価者ごとに異なる主観的なものである。もし、最も重要なアウトカムが100であるアウトカムの重要度が20に設定すると、最も重要なアウトカムはそのアウトカムの5倍重要とみなしたことになる。もし、どちらも益のアウトカムであった場合、そのアウトカムが5人に生起した価値は最も重要なアウトカムが1人に生起した価値と同じと考えたことになる。なお、Gail/NCIのオリジナルの方法では重要度を重要、中等度、重要でないの3段階で、1, 0.5, 0という値を設定する。さらに、感度分析では例えば、1,0.5,0.25/1.0,1.0,1.0/1.0,1.0,0など異なる値を設定する。
アウトカムの重要度をそれぞれアウトカムの重要度の総和で割り算して、標準化した値がwskである。標準化することによって、アウトカムの数を増やしても正味の益NBの値の絶対値は最大で100を超えることが無くなる。また、最も重要なアウトカムの重要度に対する比の値を用いることもできる。その場合は、正味の益は最も重要なアウトカムに相当する価値のアウトカムが生起した対象者の割合または人数を表すことになる。なお、アウトカムの重要度と価値は同じ意味であり、文脈により使い分けられる。
正味の益NB(Net Benefit)は図1でNBとして示す式で計算される。各アウトカムごとにFk、標準化した重要度、リスク差を掛け算した値をすべてのアウトカムについて加算し、総和を求めた値になる。効果の大きさをアウトカムの重要度で重みづけした総和と言える。ただし、望ましい効果はプラス、望ましくない効果はマイナスになるようにして総和を求める。なお、正味の益net benefitと益と害のバランス benefit-harm balanceは同じ意味である。また、Benefit-harmではなくBenefit-riskあるいはRisk-benefitという用語が用いられる場合もある。
アウトカム1~Tの中の一つ、アウトカムLの効果推定値=リスク差について、正味の益NBが正負逆転する閾値は、正味の益からアウトカムLについて、Fk、標準化した重要度、リスク差を掛け算した値を引き算して、正負を逆にし、それをアウトカムLの標準化した重要度wslで割り算することで求められる。アウトカムLについて、Fk、標準化した重要度、リスク差を掛け算した値は、介入により得られる分の効果を表している。このように閾値を求める場合、そのアウトカム以外のアウトカムに対するリスク差と重要度の値は同じのままということが前提である。
アウトカムLの重要度について、正味の益NBが正負逆転する閾値は、正味の益からアウトカムLについて、Fk、標準化した重要度、リスク差を掛け算した値を引き算して、正負を逆にし、それをアウトカムLのリスク差EijLで割り算することで求められる。この場合、上記の場合と同様、そのアウトカム以外のアウトカムに対するリスク差と重要度の値は同じのままということが前提である。

正味の益が反転しない、効果推定値(リスク差)の範囲、および、アウトカムの重要度の範囲は、アウトカムLに対するリスク差EijLと閾値の大小関係から容易に知ることができる(図2)。
EijLの正味の益が反転しない範囲は、EijLが閾値より大きければ、閾値から1までの範囲が正味の益が反転しない効果推定値(リスク差)の範囲となる。逆に、EijLが閾値より小さければ、-1から閾値までの範囲が正味の益が反転しない効果推定値(リスク差)の範囲となる。
いずれの場合であれ、この範囲外の効果推定値が得られる可能性が低ければ、アウトカムLに対する効果推定値が変動したとしても正味の益が反転する可能性は低いと考えていいことになる。効果推定値の95%信頼区間とバイアスリスク、非直接性、非一貫性、出版バイアスなどを考慮しても、この範囲外の値になる可能性がほとんどないと言えるくらい低ければ、そのアウトカムに関するエビデンス総体のエビデンスの確実性は高いと判断できる。
アウトカムの重要度については、アウトカムLに対して設定した重要度wLの値が、閾値より大きい場合は、閾値から(もし閾値がマイナスの値の場合は0から)100までの範囲が正味の益が反転しないアウトカムの重要度の範囲となる。逆に、重要度wLが閾値より小さい場合は、0から閾値まで(もし閾値が100以上の場合は100まで)の範囲が正味の益が反転しない範囲となる。
重要度についても、この範囲外の値がありえない値と考えられる場合、アウトカムの重要度を変動させても、正味の益が反転する可能性は低いと考えることができる。特に、効果の大きさが小さい場合は、そのような範囲になる可能性が高くなる。アウトカムの重要度の判定は個人差があるが、その振れ幅を考慮しても正味の益が反転する可能性が低ければ、大部分の人に適用しても価値観の相違による問題は起きないであろうと考えることができる。
ここで述べた方法は、”閾値分析 “Threshold analysis“と呼ばれ(Phillippo DM 2019)、エビデンスの確実性の評価、正味の益の確実性の評価に有用と考えられる。
文献:
Gail MH, Costantino JP, Bryant J, Croyle R, Freedman L, Helzlsouer K, Vogel V: Weighing the risks and benefits of tamoxifen treatment for preventing breast cancer. J Natl Cancer Inst 1999;91:1829-46. doi: 10.1093/jnci/91.21.1829 PMID: 10547390
URL: https://pubmed.ncbi.nlm.nih.gov/10547390/
MCDAについて広く解説されている。Keeney & Raiffaの方法の実例の解説がある。
Thokala P, Devlin N, Marsh K, Baltussen R, Boysen M, Kalo Z, Longrenn T, Mussen F, Peacock S, Watkins J, Ijzerman M: Multiple Criteria Decision Analysis for Health Care Decision Making-An Introduction: Report 1 of the ISPOR MCDA Emerging Good Practices Task Force. Value Health 2016;19:1-13. PMID: 26797229
URL: https://pubmed.ncbi.nlm.nih.gov/26797229/
上記のThokala Pの報告の後半に相当し、ISPORの公式の報告として出版されている。
Marsh K, IJzerman M, Thokala P, Baltussen R, Boysen M, Kalo Z, Lonngren T, Mussen F, Peacock S, Watkins J, Devlin N, ISPOR Task Force: Multiple Criteria Decision Analysis for Health Care Decision Making-Emerging Good Practices: Report 2 of the ISPOR MCDA Emerging Good Practices Task Force. Value Health 2016;19:125-37. PMID: 27021745
URL: https://pubmed.ncbi.nlm.nih.gov/27021745/
効果推定値の不確実性から正味の益の不確実性を推定する方法。
Wen S, Zhang L, Yang B: Two approaches to incorporate clinical data uncertainty into multiple criteria decision analysis for benefit-risk assessment of medicinal products. Value Health 2014;17:619-28. PMID: 25128056
URL: https://pubmed.ncbi.nlm.nih.gov/25128056
GRADEワーキンググループの益と害のバランス=正味の益に関するコンセプトペーパー。Certainty of net benefitという考えは、USPSTFと同じで、推奨の強さを決める主要要素。Appendixに具体的な計算法が記載されている。
Alper BS, Oettgen P, Kunnamo I, Iorio A, Ansari MT, Murad MH, Meerpohl JJ, Qaseem A, Hultcrantz M, Schunemann HJ, Guyatt G, GRADE Working Group: Defining certainty of net benefit: a GRADE concept paper. BMJ Open 2019;9:e027445. PMID: 31167868
URL: https://pubmed.ncbi.nlm.nih.gov/31167868/
定量的ベネフィット・リスク分析に関するISPORの公式の報告。実際的な手順を解説。
Tervonen T, Veldwijk J, Payne K, Ng X, Levitan B, Lackey LG, Marsh K, Thokala P, Pignatti F, Donnelly A, Ho M: Quantitative Benefit-Risk Assessment in Medical Product Decision Making: A Good Practices Report of an ISPOR Task Force. Value Health 2023;26:449-460. doi: 10.1016/j.jval.2022.12.006 PMID: 37005055
URL: https://pubmed.ncbi.nlm.nih.gov/37005055/
患者の嗜好を取り入れるための枠組みに関する、規制当局のコンソーシアムの報告書。アウトカムの重要度を決める様々な方法のリストがある。
Ho M, Saha A, McCleary KK, Levitan B, Christopher S, Zandlo K, Braithwaite RS, Hauber AB, Medical Device Innovation Consortium’s Patient Centered Benefit-Risk Steering Committee: A Framework for Incorporating Patient Preferences Regarding Benefits and Risks into Regulatory Assessment of Medical Technologies. Value Health 2016;19:746-750. PMID: 27712701
URL: https://pubmed.ncbi.nlm.nih.gov/27712701/
Phillippo DM, Dias S, Welton NJ, Caldwell DM, Taske N, Ades AE: Threshold Analysis as an Alternative to GRADE for Assessing Confidence in Guideline Recommendations Based on Network Meta-analyses. Ann Intern Med 2019;170:538-546. doi: 10.7326/M18-3542 PMID: 30909295
URL: https://pubmed.ncbi.nlm.nih.gov/30909295/
Eiring Ø, Brurberg KG, Nytrøen K, Nylenna M: Rapid methods including network meta-analysis to produce evidence in clinical decision support: a decision analysis. Syst Rev 2018;7:168. doi: 10.1186/s13643-018-0829-z PMID: 30342549
URL: https://pubmed.ncbi.nlm.nih.gov/30342549/