International Society for Pharmacoeconomics and Outcomes Research (ISPOR) 国際医薬経済・アウトカム研究学会の ISPOR MCDA Emerging Good Practices Task ForceがMCDAに関するガイダンスをReport 1およびReport 2として2016年に発表しています。
Steps in a value measurement MCDA process として8つのステップが挙げられています。Value measurementという言葉が用いられ、薬物療法の価値を定量的に評価するという意味だと思われます。
1.Defining the decision problem
2.Selecting and structuring criteria
3.Measuring performance
4.Scoring alternatives
5.Weighting criteria
6.Calculating aggregate scores
7.Dealing with uncertainty
8.Reporting and examination of findings
Report 2ではこれらに基づいたチェックリストも掲載されています。
診療ガイドライン作成のプロセスにおけるステップをこれらに対応してリストアップすると次の様になると思います。(これは、著者が作成したものです。)
1.Finding KCI and formulating CQ
2.Setting outcomes
3.Calculating effect estimates with SR
4.Comparing absolute effects
5.Setting importance of outcomes
6.Evaluating benefits and harms
7.Doing sensitivity analysis
8.Developing SoF and EtD framework with graphs
* KCI: Key Clinical Issue, CQ: Clilnical Question, SR: Systematic Review, SoF: Summary of Findings, EtD: Evidence-to-Decision . SoF、EtDはGrading of Recommendations, Assessment, Development and Evaluation (GRADE) approachに基づくステップです。
同じ概念を異なる言葉で表現しているため、異なる作業のようにみえますが、実際には同じ作業のものが多いです。しかし、4のscoringとabsolute effectsは同じではありません。6のaggregate scoresの計算と単なるbenefit-harmの評価も違います。
最近GRADE concept paperとしてDefining certainty of net benefitという論文が発表されています。この中で、アメリカUSPSTFの”certainty of net benefit”のことも引用されていますし、イギリスNICEのDecision Analylsisの活用についても触れられており、GRADE working groupもDecision modellingやDecision analysisについて検討中であると述べています。ただし、ISPORの論文は引用されていません。この論文で”A stepwise approach to determining the certainty of the net effect estimate”では以下のステップが記述されています。
1.Determine the outcomes to be combined.
2.Determine the quantified relative importance for each outcome.
3.Combine the importance-adjusted effect estimates.
4.Classify the precision of the net effect estimate.
5.Consider the certainty of effect estimates for outcomes that are critical to the likelihood of net benefit.
6.Determine if certainty of net benefit changes across a reasonable range of relative importance.
USPSTFの推奨Gradeについてはこの論文でも取り上げられていますが、MCDAという言葉は出てきません。しかし、複数の益と害のアウトカムに対する介入の効果を全体として定量的に評価することはMCDAそのものです。
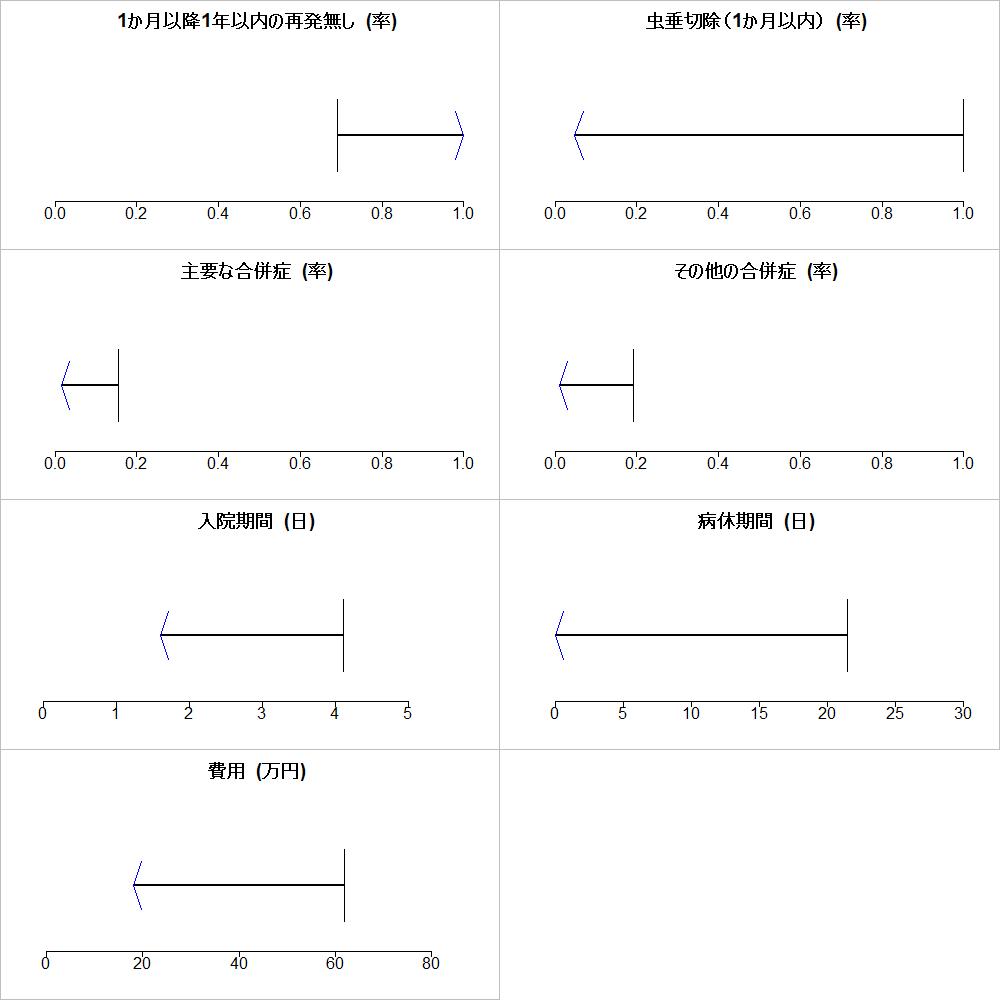
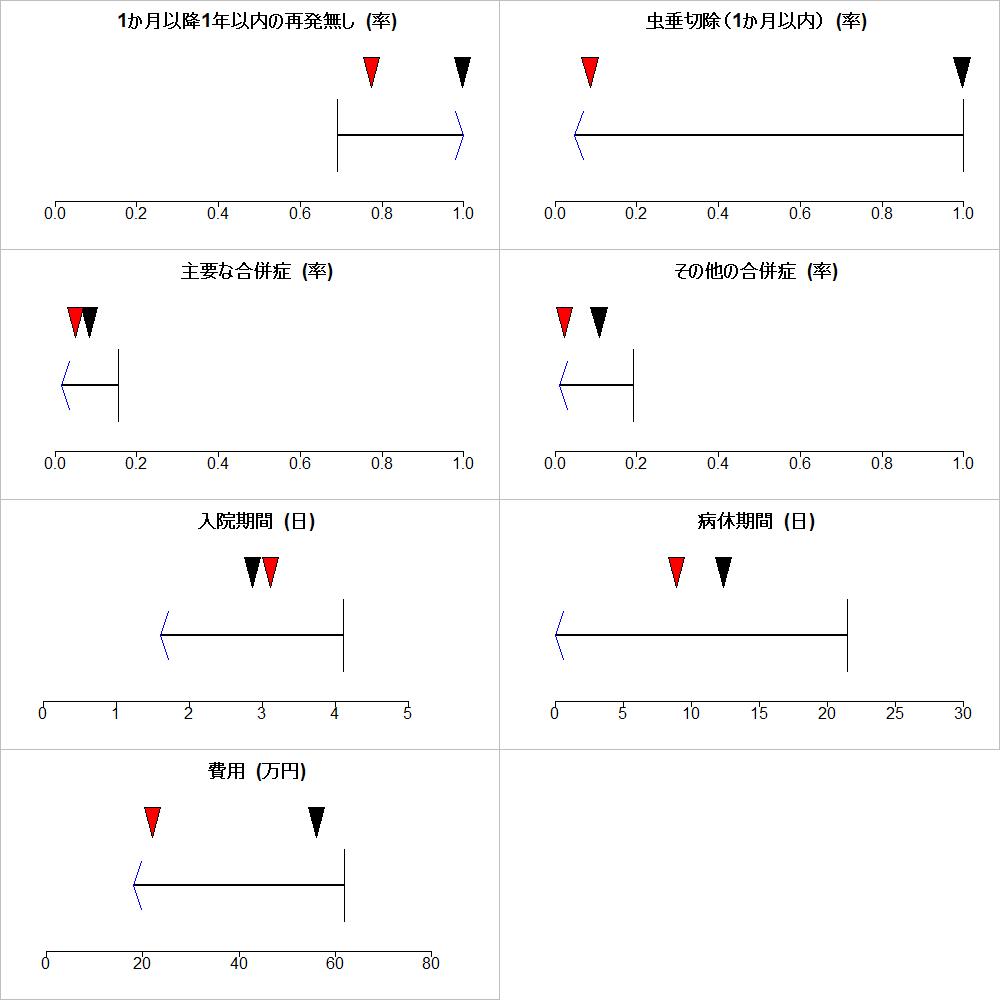
Appendixとして、実例とnet effect estimateの計算法が紹介されていますが、効果推定値は”are expressed using the same units of measure”そして、”are independent and not correlated with each other”と制限がつけられています。価値関数という考えは取り入れられていません。
また、”Classification of precision of net effect estimate”ではNet benefit, Likely net benefit, Possible net benefit, Possibly no net benefit or harm, Net benefit or harm likely near zero, Possible net harm, Likely net harm, Net harmに分類しています。それぞれが、High certainty of net benefit, Moderate certainty of net benefit, Low certainty of net benefit, Very low certainty of net benefit or harm, Moderate certainty of little net benefit or harm, Low certainty of net harm, Moderate certainty of net harm, High certainty of net harmに対応するそうです。
References:
1. Thokala P, Devlin N, Marsh K, Baltussen R, Boysen M, Kalo Z, Longrenn T, Mussen F, Peacock S, Watkins J, Ijzerman M: Multiple Criteria Decision Analysis for Health Care Decision Making–An Introduction: Report 1 of the ISPOR MCDA Emerging Good Practices Task Force. Value Health 2016;19:1-13. PMID: 26797229
2. Marsh K, IJzerman M, Thokala P, Baltussen R, Boysen M, Kaló Z, Lönngren T, Mussen F, Peacock S, Watkins J, Devlin N, ISPOR Task Force: Multiple Criteria Decision Analysis for Health Care Decision Making–Emerging Good Practices: Report 2 of the ISPOR MCDA Emerging Good Practices Task Force. Value Health 2016;19:125-37. PMID: 27021745
3.Alper BS, Oettgen P, Kunnamo I, Iorio A, Ansari MT, Murad MH, Meerpohl JJ, Qaseem A, Hultcrantz M, Schünemann HJ, Guyatt G, GRADE Working Group: Defining certainty of net benefit: a GRADE concept paper. BMJ Open 2019;9:e027445. PMID: 31167868